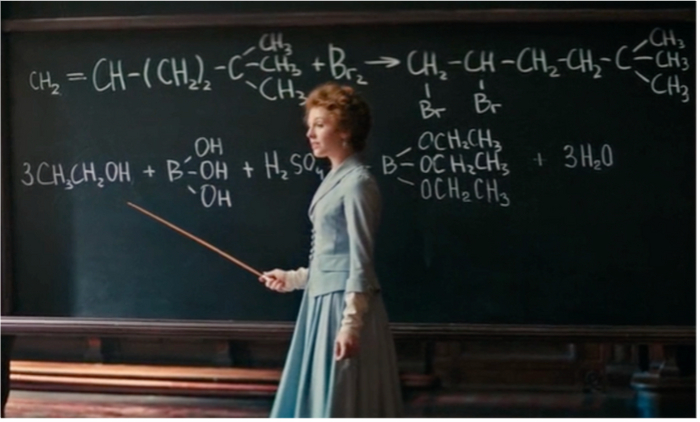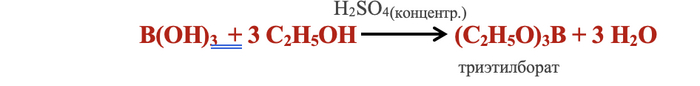Лига Химиков
Химия в фильме «Серебряные коньки»
Недавно нам на глаза попался российский фильм 2020 года «Серебряные коньки». Он рассказывает об истории любви молодых людей из разных слоев обществе начала XX века, но наиболее интересно, что героиня мечтает стать химиком, что для женщин в то время было не просто – для обучения необходимо было разрешение супруга или родителей.
Тем не менее, наша героиня по имени Алиса показывает настоящее упорство и изучает науку самостоятельно. Знание химических реакций помогает ей разоблачить «волшебство» иностранного мага, который погружает руки в огонь и не обжигается. В конце фильма Алиса – уже в статусе преподавателя – объясняет этот фокус с точки зрения химических процессов.
Давайте подумаем: Как сделать холодный огонь и можно ли его потрогать?
Холодный огонь - химический термин, означающий вид низкотемпературного пламени. Таким пламенем горят сложные органические и неорганические эфиры, например, этиловый эфир борной кислоты.
Как можно догадаться, основная особенность этого вещества в том, что его можно потрогать в буквальном смысле этого слова.
Неорганическая борная кислота В(ОН)3 (или Н3ВО3), как и другие карбоновые кислоты, способна образовывать летучие эфиры.
Смешаем борную кислоту В(ОН)3 (или Н3ВО3) с этиловым спиртом С2Н5ОН.
Добавим концентрированную серную кислоту H2SO4 (ее функция отнимать воду, т. к. в присутствие воды реакция может пойти в обратном направлении).
Нагреем смесь.
Легкокипящий борноэтиловый эфир – триэтилборат (С2Н5О)3В испаряется. При поджигании он горит красивым зеленым пламенем за счет присутствия в смеси частичек бора В.
В общем виде уравнение выглядит следующим образом:
Почему пламя видимое? Почему «холодное»? И чем определяется его яркость?
Некоторое пламя почти не видно, а другое наоборот светит очень ярко. Например, водород горит почти совершенно бесцветным пламенем; пламя чистого спирта тоже светит весьма слабо, а свеча и керосиновая лампа горят ярким светящимся пламенем.
Дело в том, что большая или меньшая яркость всякого пламени зависит от присутствия в нем раскаленных твердых частичек.
В этиловом спирте содержится углерод. Частички углерода, раньше, чем сгореть, накаливаются, оттого-то пламя светит, т. к. его подсвечивают раскаленные частицы углерода.
Таким образом, можно и несветящееся или слабо светящееся пламя сделать ярким, обогащая его углеродом или раскаляя им негорючие вещества.
Как получить разноцветное пламя?
Для получения цветного пламени к горящему веществу прибавляют не углерод, а соли металлов, окрашивающих пламя в тот или иной цвет.
Стандартный способ окрашивания слабосветящегося газового пламени - введение в него соединений металлов в форме легколетучих солей - обычно, нитратов (соли азотной кислоты) или хлоридов (соли соляной кислоты):
желтое – соли натрия,
красное – соли кальция, стронция,
зеленое – соли бора (в виде борноэтилового или борнометилового эфира) или цезия,
голубое – соли меди (в виде хлорида).
В синий окрашивает пламя селен, а в сине-зеленый - бор.
Этой способностью горящих металлов и их летучих солей придавать определенную окраску бесцветному пламени пользуются для получения цветных огней (например, в пиротехнике).
Чем определяется цвет пламени (научным языком)
Цвет огня определяется температурой пламени и тем, какие химические вещества в нём сгорают.
Высокая температура пламени дает возможность атомам перескакивать на некоторое время в более высокое энергетическое состояние. Когда атомы возвращаются в исходное состояние, они излучают свет с определённой длиной волны. Она соответствует структуре электронных оболочек данного элемента.
Вам понадобится - спирт этиловый, сухая борная кислота, капля серной или соляной кислоты.
Инструкция
1. Подготовьте основу, на которую будет наноситься смесь. Наносить раствор непосредственно на руки достаточно вредно. Именно по этой причине стоит сделать небольшие палочки или шарики, на которые можно было бы нанести огонь.
2. Возьмите шерстяную плотную нитку и намотайте небольшой клубочек. 2-3 сантиметрового клубка будет вполне достаточно, чтобы 2-4 минуты наблюдать холодное горение. Чтобы сделать своего рода факел, наматывайте нитку на спицу или карандаш.
3. Подготовьте ингредиенты для огня. Операцию желательно производить быстро и аккуратно, поэтому старайтесь, чтобы у вас всё было под рукой, и вы имели свободный доступ ко всем составляющим состава пламени. Следите, чтобы не происходило досрочного смешения, так как вы работаете с весьма сложными и опасными веществами.
4. Возьмите небольшую чашку и вылейте в неё столовую ложку спирта. После чего добавьте туда же сухой борной кислоты (тоже ложку) и добавьте одну каплю серной или соляной кислоты. Будьте аккуратны в пропорциях. Желание сделать "поярче" может привести к отравлению и другим негативным последствиям.
5. Подогрейте получившуюся смесь. Самый безопасный способ - это при помощи пара. 2-3 минуты на пару будет вполне достаточно. Попробуйте кончиком пальца, если кожа терпит, значит всё в норме.
6. Будьте внимательны. Как только вы промочите шарик и подожжете его, начнет гореть борная кислота. Она не будет обжигать и даже ощутимо греть руки. Но будьте готовы, что, как только бор выгорит, начнет гореть спирт, а его пламя вполне ощутимо.
Полезный совет
Чтобы резко затушить пламя, достаточно перекрыть доступ воздуха. Сожмите ладонь с шариком или обмотайте руку полотенцем.
Сбрейте лишние волосы с рук. Вы можете не уследить за моментом, когда одно пламя сменится другим. Волосы особо не жалко, но вот запах, который останется, придется выводить еще очень долго.
Ну, вот теперь вы знаете почему пламя видимое и «холодное» и чем определяется его яркость.
Свинец: от Римского водопровода до загрязнения планеты – геоэколог Захар Слуковский | Научпоп
Чем интересен свинец? К какому времени относятся первые свидетельства применения этого металла? Кто и как его использовал в различные периоды истории? Какой вред для человека представляет свинец? Какие известны исторические случаи отравления свинцом? Когда и как свинец начал загрязнять планету? Почему его перестали добавлять в бензин? Какие последствия от загрязнения свинцом можно спрогнозировать?
Рассказывает Захар Слуковский, геоэколог, сотрудник Института проблем промышленной экологии Севера Кольского научного центра РАН.
Анодирование больших плоскостей. Как?
Всем привет! Значит ситуа такая: работаю распиловщиком на мебельном производстве. Пилю, соответственно, на форматно-раскроечном станке (на пиле, по простому). У станка есть алюминиевая анодированная каретка, по которой двигается лист ДСП и это анодирование со временем стирается и алюминий начинает пачкать листы. Вопрос: есть ли способ как-то восстановить покрытие или сделать существующее более устойчивым к истиранию? Желательно зонально, не целиком, чтобы без демонтажа и окунается каретки в огромную ванну с электролитом.
upd.: Простая краска и всякие наклейки не подойдут. За пару дней сотрутся, к тому же сами следы на материале оставляют.
Азот - безжизненный кормилец
Всё это и прочее на странице ВК:
https://vk.com/mircenall
Другие посты этой серии:
Титан. Алюминий. Ртуть. Осмий. Вольфрам. Медь. Цезий. Фтор. Хром. Свинец. Висмут. Углерод. Водород. Серебро. Палладий. Платина. Франций. Золото. Бериллий. Мышьяк. Кремний. Радон. Литий. Рутений. Тантал. Молибден. Рений. Иридий. Технеций. Родий. Церий. Таллий. Магний. Селен. Никель. Калифорний. Сера. Цирконий. Железо. Германий. Цинк. Уран. Кальций. Олово. Индий. Галлий.
Разъясните про ионообменную смолу
В анализе воды наблюдаю катионы (Ca+, Mg+) и анионы (хлориды, сульфаты SO4, нитраты NO3, гидрокарбонаты HCO3).
Предлагают на такой коктейль поставить обратный осмос, но перед ним советуют установить умягчение, поскольку кальция свыше 400 мг/л
Теперь вопрос по выбору смолы: если кальций в воде является катионом, мне надо какую смолу засыпать в колонну? Катионит или анионит?
Просто уже имею в наличии 25 кг катионита Токем 100 Na.
Есть в продаже также Феррософт, пишут, что там микс из анионита и катионита, а также обезжелезивающей засыпки.
Также нашел в продаже недорого 25 кг Purolite A400mboh.
Подскажите, какую смолу сыпать для извлечения кальция?
Занятный эксперимент
Можно будет забыть про мозоли на руках
Янтарь и синтетическая смола - родственники?
Родственники или нет янтарьи синтетическая смола? Попробуем разобраться!
Начнем с янтаря.
Янтарь – это солнечный камень. Такое название получил он благодаря своему яркому окрасу желтого цвета. На солнце он переливается и имеет очень необычный оттенок. В некоторых источниках можно встретить другие его названия – Слезы моря или Дар солнца.
Впервые человек познакомился с янтарем в эпоху неолита. Этот самоцвет представлял большую ценность и еще тогда его умели правильно обрабатывать. Согласно данным, древние люди ценили янтарь за красоту и необычный вид. Первое описание было сделано в 10 веке до нашей эры. Сейчас экземпляры того времени можно посмотреть в музее Лондона.
Ученые не одно тысячелетние пытались постичь уникальную структуру камня.
Чем же образован янтарь?
Химическая формула — C10H16O + (H2S).
Состав янтаря:
– углерод С – 79 %, Н – 10,5 % и кислород О – 8,5 %, остальное S.
Основные особенности янтаря:
- янтарь не тонет в соленой воде;
- при контакте с пресной водой янтарь разбухает;
- увеличение объема ощутимо только, если камень находится в воде длительное время;
- при взаимодействии с кипятком янтарь превращается в смолу;
- растворим в кислотах, некоторых маслах и спирте;
- легко подвергается изменению плотности и окраса;
- проводит электричество;
- при разных температурах камень изменяет свою структуру. При температуре до 150 0С он становится мягким, от 1500С до 3500С – начинает плавиться, а от 3500С до 10000С – вовсе исчезает.
Применяется янтарь для лечения желтухи, заболеваний горла и глаз, поражение органов человека и зубной боли. А еще обладает магическими свойствами - это камень молодости, он наполняет крепким здоровьем изнутри и дарит бодрость на целый день тем, кто янтарь носит. Поэтому самая популярная сфера использования янтаря – это ювелирное искусство.
Ну а теперь давайте разберемся с синтетическими смолами!
В настоящее время существует два промышленных способа получения синтетических смол: поликонденсация и полимеризация.
Поликонденсация – это сложный процесс, он протекает по принципу замещения и, как правило, сопровождается образованием побочных низкомолекулярных продуктов.
Поликонденсация бывает гомо- или гетеро-типа, равновесная и неравновесная. Конечный результат зависит от количества реакционноспособных групп в молекуле и их происхождения.
Одной из наиболее востребованных сегодня смол являются карбамидные смолы. Ее получают поликонденсацией формальдегида с мочевиной. Данные вещества являются исходными соединениями, то есть мономерами, включающими одну или несколько групп, каждая из которых выполняет определенную функцию. При их взаимосвязи образуется новая группа, связывающая остатки реагирующих молекул.
Поликонденсация бывает гомо- или гетеро-типа, равновесная и неравновесная. Конечный результат зависит от количества реакционноспособных групп в молекуле и их происхождения.
Производство смол сопряжено с определенными трудностями. Они взрывоопасны, поэтому на заводах-изготовителях используют реакторы, конденсаторы, вакуумное оборудование и другое специальное оборудование. При получении составов необходима регулярная очистка оборудования, а также обязательным является наличие собственных площадок и химических лабораторий, и, безусловно, присутствие квалифицированных сотрудников.
Процесс поликонденсации представляет собой соединение разнородных мономеров, в результате которого получается полимер и выделяется побочный продукт.
Таким способом изготавливается, например, карбимидоформальдегидная смола, в основе которой – формальдегид и мочевина.
Таким же образом можно получить и меламиноформальдегидную смолу.
Основные особенности синтетических смол, в частности карбамидоформальдегидной смола
Для получения карбамидных смол резольного типа реакцию поликонденсации ведут при избытке формальдегида на 1 моль карбамида, т. е. формальдегид и карбамид берут в соотношении (1,1...2):1.
Для получения клеящих смол в реакции поликонденсации всегда должно быть больше формальдегида. При взаимодействии карбамида с недостаточным количеством формальдегида образуются вещества, не обладающие клеящими свойствами. Реакцию ведут в среде с переменной кислотностью, то есть сначала в нейтральной или слабощелочной среде, pH = 7-8, а затем в кислой.
В качестве отвердителя для карбамидоформальдегидных смол горячего отверждения наиболее широко применяют хлорид аммония NH4Cl. В производстве клееных материалов карбамидоформальдегидные смолы применяют в качестве клеев горячего и холодного отверждения.
Поговорим о КФС горячего отверждения:
КФ-0 - карбамидоформальдегидная смола общего назначения, нашла применение в производстве фанеры, для склеивания бумаги, в строительной промышленности и для других целей;
КФ-Б - карбамидоформальдегидная смола быстрого отверждения, применяется в производстве фанеры, при склеивании массивной древесины, теплоизоляционных материалов, деталей мебели;
КФ-Ж - карбамидоформальдегидная смола повышенной жизнеспособности, используется в производстве фанеры, при склеивании деталей мебели, столярно-строительных изделий и других целей;
КФ-БЖ - карбамидоформальдегидная смола быстрого отверждения и повышенной жизнеспособности, применяется в производстве фанеры, при склеивании деталей мебели, столярно-строительных изделий.
Смола КФ-А представляет собой невакуумированный продукт конденсации карбамида с формальдегидом. В процессе её получения стадия вакуум-сушки, применяемая для удаления воды из смолы с целью повышения её концентрации, отсутствует. При хранении сохраняет стабильные свойства. Отличительной особенностью карбамидной смолы марки КФ-А в сравнении со смолами, полученными по традиционной технологии, является то, что она получается при синтезе исходных продуктов без образования токсичных над смольных сточных вод.
Параметры, характеризующие свойства этих смол, согласно ГОСТ 14231, приведены ниже.
Внешний вид - однородная суспензия от белого до светло-желтого цвета без посторонних включений.
В зависимости от марки смолы:
ü массовая доля нелетучих веществ составляет от 53% до 70 %;
ü условная вязкость при (20,0±0,5°С) от 15 до 300 с;
ü массовая доля свободного формальдегида - не более 0,9%;
ü концентрации водородных ионов, pH = 6,8 - 8,5;
ü время желатинизации: - при 100 °С, от 30 до 70с;
- при (20±1) °С не менее 2 ч.
Полимеризация – это соединение мономеров в одну сложную молекулу без выделения посторонних веществ. При этом получают инден-кумароновые, нефтеполимерные смолы. Одним из главных видов сырья для получения большой группы смол выступают нефть и природный газ.
Современная технология получения формалина состоит в окислении метанола кислородом воздуха с использованием металлооксидного катализатора, что позволяет достичь, практически полной (более 99 %), конверсии метанола и получить безметанольный формалин концентрацией 55,5 %. Дальнейшее проведение синтеза высококонцентрированного формалина и карбамида обеспечивает получение безметанольного карбамидоформальдегидного концентрата.
Применение КФК вместо обычного товарного формалина при синтезе карбамидоформальдегидных смол обусловливает получение смолы 60-70 % концентрации. При этом вакуум-сушка не проводится, а значит, сточные воды не образуются.
Обязательным условием изготовления синтетических смол является соблюдение требований ГОСТ на карбамидоформальдегидную смолу и контроль всех стадий производства опытными специалистами.
Карбамидоформальдегидные смолы применяют:
- в производстве картонного и бумажного материала с пропиткой, устойчивой к повышенной влажности;
- при изготовлении отделочных материалов и строительных, например, древесностружечных плит и фанер;
- при выпуске лаков, красок, шпаклевочных смесей,;
- для получения пенопласта.
НАДЕЮСЬ ТЕПЕРЬ У ВАС ПОЛУЧИТСЯ ОТЛИЧИТЬ ЯНТАРЬ ОТ СИНТЕТИЧЕСКОЙ СМОЛЫ?
И в завершении, предлагаю вам способы определения подлинности янтаря в домашних условиях.
1. Визуальная проверка янтаря
Настоящие янтарные бусины имеют неповторимый внешний вид, поэтому ищем несовершенства - крошечные трещины и пузырьки воздуха, разный размер не обязательно круглая форма. Настоящий янтарь на ощупь, как правило, слегка теплый. Чего не скажешь об искусственной смоле.
2. Проверка соленой водой
Для проверки понадобится примерно 7 чайных ложек соли и 200 мл воды среднего размера. Добавьте всю эту соль в воду и хорошо перемешайте до полного растворения. Затем положите в воду камень янтаря. Настоящий янтарь должен легко плавает в воде в отличие от синтетической смолы (она тонет).
3. Проверка трением
Поскольку настоящий янтарь обладает электростатическими свойствами, он, при достаточной зарядке, способен притягивать крошечные кусочки бумаги и пылинки. Чтобы зарядить, заверните его в ткань и потрите янтарь об тряпочку примерно 20-60 секунд. После этого поднесите камень к пряди волос. Если волосы притягиваются к нему, значит, образовалось статическое электричество, и у вас в руках, скорее всего, настоящий янтарь. И наоборот, если это смола синтетическая данного эффекта вы не увидите.