Правила общежития электронов внутри атома
Вы никогда не задумывались, почему таблица Менделеева выглядит так «неровно»? В этом посте я постараюсь рассказать, почему.
В прошлом посте были упомянуты энергетические уровни атома, на которых находятся его электроны. Чем ближе к ядру, тем меньше энергия электрона. Если электрон «возбудить» (например, скормить ему фотон определённой частоты), то электрон сможет подскочить на один из более высоких уровней). В физике данные уровни нумеруют по порядку, начиная с ближайшего уровня к ядру, и называют эти числа главным квантовом числом, с обозначением n. По нему мы можем судить о том, какой энергией обладает электрон.
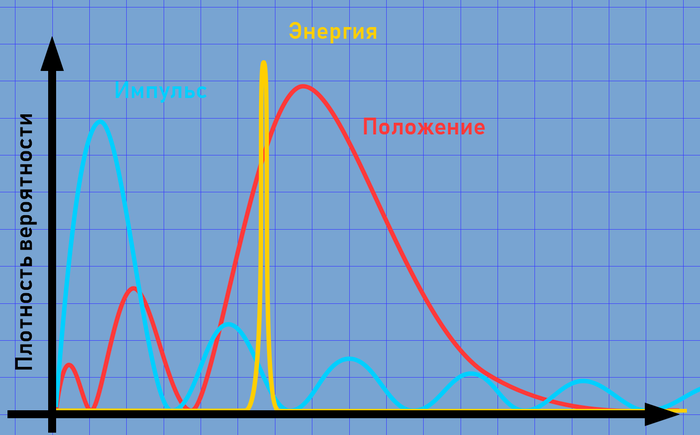
Так же было упомянуто уравнение Шрёдингера. В классической механике мы используем Второй закон Ньютона (F = ma) для того, чтобы предсказать изменение физической системы со временем при известных начальных условиях. Если решить данное уравнение, можно получить новое положение и импульс системы, как функцию внешней силы F, действующей на систему.
Данных двух параметров (положение и импульс) достаточно для того, чтобы описать состояние системы в любой момент имени. В мире квантовых систем (атомов, молекул, субатомных частицах и т. д.), в силу действия принципа неопределённости Гейзенберга (которого я уже касался), мы не можем знать одновременно и положение, и импульс системы. Грубо говоря, мы можем знать некоторые характеристики только «приблизительно» или «с определённой вероятностью». Поведение объекта можно описать лишь волновой функцией, которая свяжет вместе все факты о свойствах частицы, а решая уравнение Шрёдингера с этой волновой функцией можно получать распределение вероятностей той или иной характеристики.
Используя одну и ту же волновую функцию, можно построить графики всех свойств частицы. В принципе, при помощи преобразования Фурье можно выразить одно свойство через другое (положение через импульс и обратно), но это сейчас не важно.
Положение и импульс электрона нам особой пользы не приносит, так как он может быть где угодно, скорее там, где соответствующий график выпирает повыше. Но больше пользы будет от определённых, «стационарных состояний» (таких состояний, которые не изменяются во времени). Например, энергию частицы, одновременно с которой мы можем измерять так же величину и ориентацию вектора момента импульса. Момент импульса оказался важен для «орбитали» электрона.
Термин «орбиталь» остался с нами со времён планетарной модели атома. Его ассоциация с орбитой (планеты) сослужила дурную службу не одному поколению студентов. Лучше бы сейчас использовали другой термин. С другой стороны для объектов квантового мира очень сложно подбирать аналоги из того, что можно представить или пощупать. Наиболее приближённой (однако, по-прежнему неверной) аналогией будет представление электрона в виде «облака» или «атмосферы» вокруг ядра, где-то оно «плотнее», где-то «разряжённее» – в «плотных» областях вероятность обнаружить электрон выше. Причём, данное облако может принимать разные формы, в зависимости от наличия соседей и энергии. Так что электроны не летают вокруг ядра, однако они имеют как линейный импульс, так и угловой момент (момент импульса).
Так какое отношение момент импульса имеет к «орбитали»? Орбиталь лучше всего рассматривать как составную часть энергетического уровня, она показывает, какую форму могут принимать электронные «облака». Анализируя распределение вероятностей, удалось установить, что чем дальше энергетический уровень от ядра атома, тем больше на этом уровне «места» (на самом деле, степеней свободы), соответственно, тем больше электронов может такой уровень вместить. Наличие «соседей» искажают форму «облака». Я немного упрощаю, но орбиталь – это величина вектора углового момента электрона.
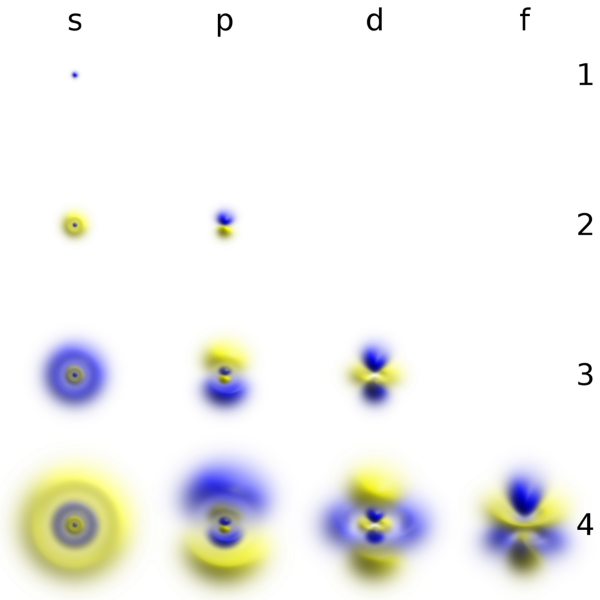
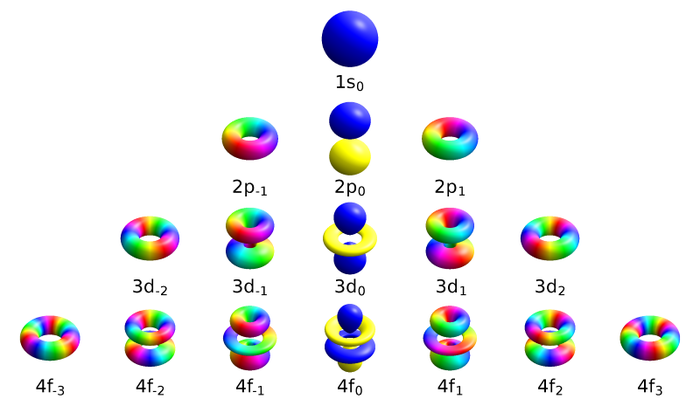
Чтобы описать тип орбитали на энергетическом уровне, мы используем второе орбитальное квантовое число l, которым мы будем обозначать количество возможных типов орбиталей на данном уровне (n). Впрочем, исторически сложилось так, что типы орбиталей обозначают ещё и буквами s, p, d, f. (Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная). На рисунке сверху вниз – номера уровней, слева направо – типы орбиталей, а их форма — на пересечении:
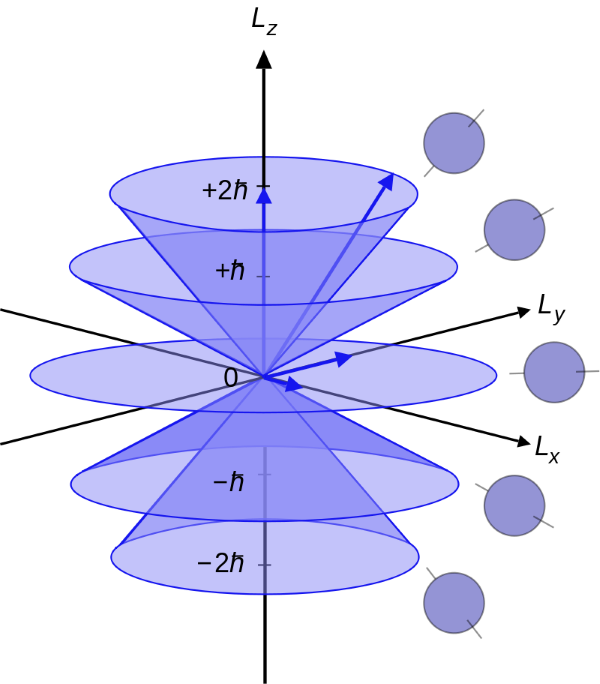
Как, надеюсь, все знают, угловой момент – это векторная величина, а вектор имеет не только скалярную величину, но и направление действия (ориентацию). Для описания орбитали мы воспользовались величиной вектора углового момента, но у нас осталось ещё и его направление. Например, на рисунке ниже можно увидеть, все возможные ориентации векторов углового момента (они образуют плоскость и 4 конуса) для орбитали l = 2 (тип d). Если мы возьмём проекции этих ориентаций на ось z, то получим кратные значения приведённой постоянной Планка: -2, -1, 0, 1, 2 – всего 5 вариантов:
Эти значения называются магнитным квантовым числом и обозначается m. Магнитным оно называется тоже исторически – в 1896 году голландский физик Питер Зееман поместил в сильное магнитное поле устройство, аналогичное водородной лампе, но наполненное парами раскаленного натрия. Обнаружилось, что в магнитном поле число линий в спектрах испускания возрастает. Спектры становятся сложными, но можно было видеть, что каждая p-линия распадается в магнитном поле на 3 новых линии, каждая d-линия — на 5, каждая f-линия — на 7 линий, а s-линии не изменяются. Поскольку орбитали атома становятся «видны» только в магнитном поле, очередное квантовое число, записывающее «адрес» орбитали в атоме, назвали магнитным квантовым числом.
Правило такое, если орбитальное квантовое число = l, то магнитные квантовые числа m могут меняться в диапазоне целых чисел от -l до l, включая 0. Визуально формы орбиталей в зависимости от трёх квантовых чисел (основного n, орбитального l и магнитного m) показаны ниже (например, конфигурация оболочка 3, орбиталь типа d, магнитный момент 1 обозначена как 3d1):
Прежде, чем идти дальше, необходимо кое-что разъяснить про то, что такое спин.
Картина, казалось бы, полная, но, как выяснилось в ходе опыта Штерна-Герлаха в 1922 году, электроны имеют собственный магнитный момент и связанный с ним момент импульса... спин. Это, наверное, самый труднопонимаемый термин квантового мира. Само слово spin означает в английском языке «быстрое вращательное движение», что в момент открытия казалось логичным – раз есть момент импульса, значит, есть вращение... Но нужно помнить – электрон не имеет размера, это точечный заряд, а безразмерная точка не может никак вращаться. Более того, если бы подобное вращение действительно имело место, а электрон имел бы размер, то для генерации подобного момента импульса, ему надо было бы вращаться быстрее скорости света... Стоит просто принять, что спин – просто ещё одно свойство частиц (как цвет у автомобиля или запах у духов), и что никакого вращения на самом деле не происходит. Просто так получилось, что у частиц есть момент импульса, будто бы они вращались.
Как и почти всё в квантовом мире, спин квантуется (имеет порции) равные полуцелым множителям приведённой постоянной Планка, так же известной, как постоянная Дирака ħ (ħ = h / 2π). Разные частицы могут иметь спин равный 0, ½ħ, 1ħ, 3/2ħ, 2ħ и т. д. Нас интересует электрон, и его спин имеет значение ½ħ либо –½ħ (иногда можно встретить, как положительный спин электрона показывают стрелкой, направленной вверх ↑, и называют «верхним электроном» а отрицательной – стрелкой вниз ↓ или «нижним электроном»).
Возьмём шар, как бы мы его не поворачивали, он при любом повороте неотличим от начального состояния. Про него можно сказать, что его спин равен 0. Возьмём теперь любой несимметричный предмет – для того, чтобы его вернуть к первоначальному виду, необходимо его повернуть на 360 градусов. Про такой объект можно сказать, что его спин равен 1. Теперь возьмём симметричное тело, например цилиндр. Если мы его повернём на 180 градусов, мы так же не сможем отличить его текущее состояние от первоначального, поскольку за полный оборот, он будет в таком состоянии дважды, его спин будет равен 2. Про спин в ½ сложнее. Такое значение по нашей логике должен иметь предмет, состояние которого вернётся к исходному за два полных оборота (720 градусов). В макро-мире тоже можно сконструировать подобные объекты (на гифке пример вращения на 2 оборота для возврата в первоначальное состояние):
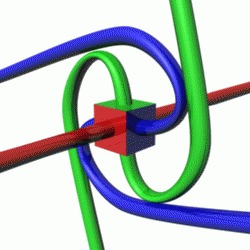
Если взять ленту Мёбиуса и представить, что по ней ползет муравей, тогда, сделав один оборот (пройдя 360 градусов), муравей окажется в той же точке, но с другой стороны листа, а чтобы вернуться в точку, откуда он начал, придётся пройти все 720 градусов.
Ещё в какой-то мере аналогом половинчатого спина может служить четырехтактный двигатель внутреннего сгорания. При повороте коленчатого вала на 360 градусов поршень вернётся в исходное положение (например, верхнюю мёртвую точку), но распределительный вал вращается в 2 раза медленнее и совершит полный оборот при повороте коленчатого вала на 720 градусов. То есть при повороте коленчатого вала на 2 оборота двигатель внутреннего сгорания вернётся в то же состояние. В этом случае третьим измерением будет положение распределительного вала. Так и электрону – ему надо повернуться дважды, чтобы вернуться к предыдущему состоянию.
Все квантовые частицы имеют спин. У некоторых значения спина – целое число, и такие частицы называют бозоны (фотоны, глюоны, W и Z бозоны и т. д.), а некоторые – полуцелое (электроны, нейтрино, мюоны, кварки, из которых состоят протоны и нейтроны), и они называются фермионами. Ещё можно сказать, что волновые функции у бозонов симметричные, а у фермионов – асимметричные.
Спин электрона является его четвёртым и последним квантовым числом – спиновым, и обозначается s. Два электрона могут находиться на одной орбитали (имея при этом совпадающие квантовые числа n, l, m, но при этом иметь разные направления спина).
Четыре квантовых числа (главное, орбитальное, магнитное и спиновое) полностью описывают состояние частицы, это своеобразный адрес электрона внутри атома.
Мы подходим к очень важному моменту – так как больше электронов на орбиталь «впихнуть» никак не получится, и никаких два фермиона (имеющих полуцелый спин) не могут иметь одинаковый набор квантовых чисел, то есть находиться в одном и том же квантовом состоянии.
То, что мы не можем нагромождать электроны друг на друга и объясняет причину, по которой вся материя должна эксклюзивно занимать определённый объём и не пропускать через себя другие материальные объекты. Это и есть Принцип запрета Паули. В то же время, это касается только фермионов (из них сделана материя), бозоны же (свет, радиация) могут при определённых обстоятельствах проходить сквозь материю, впрочем, иногда они поглощаются. Так, если вы будете стараться сблизить два электрона в одинаковых квантовых состояниях между ними возникнет дополнительное отталкивание, которое иногда ещё называют отталкиванием Паули.
Что это значит для нас? По мере роста атомного ядра, в нём растёт количество протонов, а значит – для того, чтобы атом был нейтрален, в нём должно присутствовать такое же количество электронов. Раз электроны не могут «селиться» на одной орбитали больше определённого количества, они вынуждены занимать «этажи» повыше, т. е. иметь боле высокую энергию.
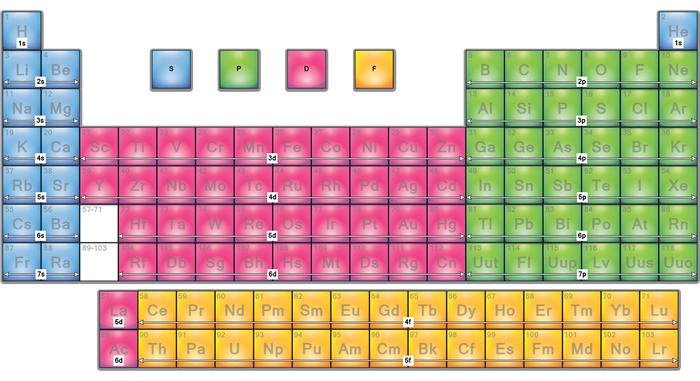
Легко посчитать, что орбиталь типа s может вместить лишь 2 электрона, на орбитали типа p можно уместить 6 электронов, в d орбитали есть место для 10 электронов, а f орбиталь вмещает 14. Теперь, думаю, многим станет очевидно, почему периодическая таблица элементов выглядит именно так:
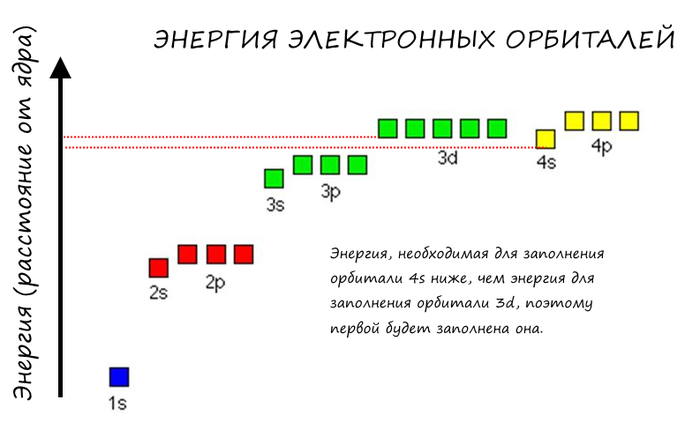
Если внимательнее приглядеться, то можно увидеть некоторое несоответствие – например следующей орбиталью за 3p идёт не 3d, а сразу 4s, что как-то нелогично. Однако в этом мире не всё так просто. Дело в том, что энергия, необходимая для начала заполнения орбитали 4s на самом деле ниже, чем энергия, необходимая для того, чтобы начать заполнение 3d:
Конфигурация электронов в атоме почти полностью определяют его химические свойства. С определённой точки зрения можно сказать, что химия – это наука об электронах и их взаимодействии. Если фотон, наверное, самый важный бозон в нашей вселенной, то самым важным фермионом является электрон.
спасибо вам за посты. обязательно продолжайте
Кланяюсь тем людям, которые в этом разбираются и делают открытия. 👏
Спасибо. Зашел подеградировать, случайно выучил квантовую механику.
Что я обожаю в таких публикациях, так это троллинг автором своих читателей фразочками типа "легко посчитать", за которыми обычно прячутся вычисления печатным объемом больше основной статьи xD
Блин, ну почему я такая тупая?